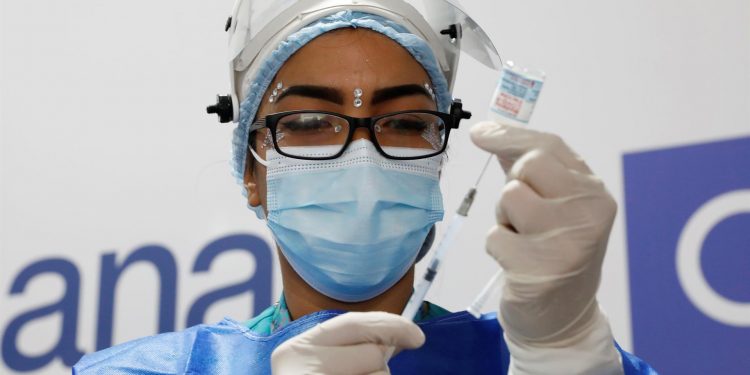
Washington, 8 dic (EFE).- La Administración de Fármacos y Alimentos (FDA, en inglés) de EE. UU. aprobó el uso de emergencia de un medicamento de AstraZeneca para prevenir el contagio de coronavirus destinado a quienes por su condición médica no pueden ponerse una vacuna.
En un comunicado, la FDA explica que este producto solo se autoriza para personas no contagiadas ni expuestas que tengan un sistema inmune que no les permita vacunarse o un historial de reacciones adversas a las vacunas.
Las vacunas han demostrado ser la mejor defensa contra el COVID-19, pero hay individuos inmunodeprimidos que pueden no ver aumentada la respuesta inmunitaria que da la vacuna y que necesitan una alternativa de prevención, dijo en el comunicado Patrizia Cavazzoni, directora del Centro de Evaluación e Investigación de Fármacos de la FDA.
Reino Unido reintroduce restricciones para frenar la expansión de ómicron
Combinación de anticuerpos
El medicamento, denominado Evusheld, consiste en una combinación de dos anticuerpos monoclonales y se administra en dos inyecciones consecutivas, una por anticuerpo.
Está indicado para ciertos adultos y pacientes pediátricos de más de 12 años con un peso de al menos 40 kilogramos.
Evusheld no está autorizado para el tratamiendo de COVID-19 o para prevención tras posible exposición al virus. Tampoco es un sustituto de la vacuna, como recalca la FDA.
Lea también:
Tedros: El mundo puede evitar que la variante ómicron genere otra crisis global
km/dm